La
tabla periódica de los elementos clasifica, organiza y distribuye los distintos
elementos químicos, conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos.
Suele atribuirse la tabla a
Dmitri Mendeléyev, quien ordenó los elementos basándose en las propiedades químicas de los elementos,
1si bien
Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los
átomos.
2La forma actual es una versión modificada de la de Mendeléyev; fue diseñada por
Alfred Werner. En 1952, el científico costarricense
Gil Chaverri (1921-2005) presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite colocar las series lantánidos y los actínidos en una secuencia lógica de acuerdo con su número atómico.
3Tabla periódica de los elementos4
El
descubrimiento de los elementos químicos conocidos que existen en la actualidad se presenta aquí en orden cronológico. Los
elementos químicos están listados aquí en el orden en que cada uno fue descrito por primera vez como elemento puro, ya que la fecha exacta del descubrimiento de la mayoría de los elementos no puede ser definida con precisión.
Se indica el nombre de cada elemento, su
número atómico, año del primer artículo o informe, el nombre del descubridor, y algunas notas relacionadas con el descubrimiento.
| He |
| Li | Be | | B | C | N | O | F | Ne |
| Na | Mg | | Al | Si | P | S | Cl | Ar |
| K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| Antes de 1800 | 1800-1849 | 1850-1899 | 1900-1949 | 1950-2000 | 2001-presente |
|
Leyenda
- Antes de 1800 (34 elementos): descubrimientos durante y antes del Siglo de las Luces.
- 1800-1849 (+24 elementos): Revolución científica y Revolución industrial.
- 1850-1899 (+26 elementos): el periodo de las clasificaciones de los elementos recibió el impulso del análisis de los espectros: Boisbaudran, Bunsen, Crookes, Kirchhoff, y otros "cazadores de trazas en las líneas de emisión de los espectros".
- 1900-1949 (+13 elementos): impulso con la antigua teoría cuántica y la mecánica cuántica.
- 1950-2000 (+17 elementos): descubrimientos "después de la bomba atómica": elementos de números atómicos 98 y posteriores (colisionadores, técnicas de bombardeo).
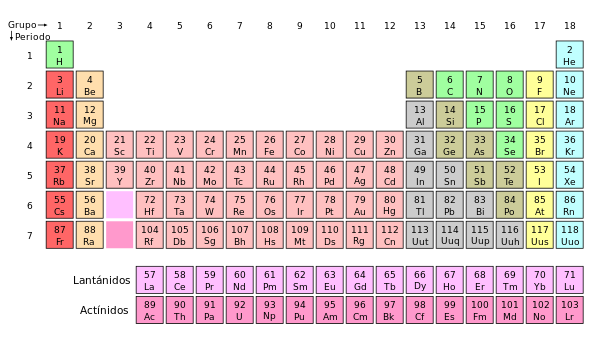
- 2001-presente (+4 elementos): descubrimientos muy recientes, que no están confirmados.La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha. Se colocan de izquierda a derecha y de arriba a abajo en orden creciente de sus números atómicos. Los elementos están ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas verticales llamadas grupos o familias.8
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos. Hay 18 grupos en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos: la tabla periódica se ideó para ordenar estas familias de una forma coherente y fácil de ver.
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, entendido como el número de electrones en la última capa, y por ello, tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicassimilares y la misma valencia atómica, o número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares.
Por ejemplo, los elementos en el grupo 1 tienen una condiguración elecrónica ns1 y una valencia de 1 (un electrón externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son también llamados gases inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre paréntesis según el sistema estadounidense, 9 los grupos de la tabla periódica son:
Períodos
| 1s | | | | | |
| 2s | | | | | 2p |
| 3s | | | | | 3p |
| 4s | | | | 3d | 4p |
| 5s | | | | 4d | 5p |
| 6s | | | 4f | 5d | 6p |
| 7s | | | 5f | 6d | 7p |
Las filas horizontales de la tabla periódica son llamadas períodos o familias. El número de niveles energéticos que tiene un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden:
|
No hay comentarios:
Publicar un comentario